Geenivaramu: mis, kuidas ja milleks?Ants Kurg |
|
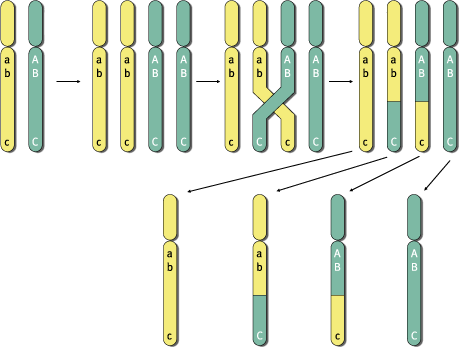
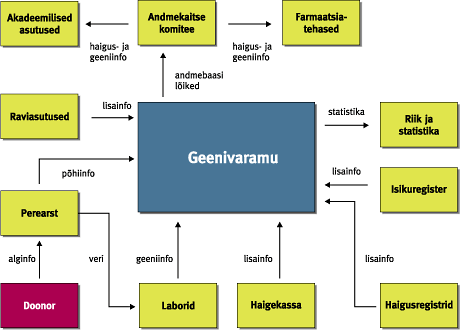
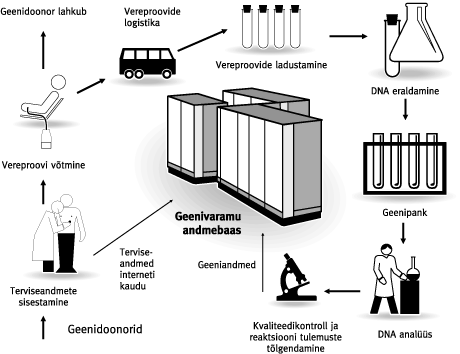
Viimasel ajal on Eesti teadlaskonda ja avalikkust köitnud geenivaramu (GV) loomise idee. Käesolevas artiklis püüan lähemalt vaadelda GV-ga seotud probleemide ringi ning leida vastused küsimustele, mis on GV, kuidas seda luuakse ja milline peaks olema tema praktiline väljund iga GV projektis osaleja jaoks.Geenivaramu üldine seletus võiks olla järgmine: tegemist on Eesti rahvastiku isiku-, sugupuu-, tervise- ja geeniandmeid sisaldava andmekoguga, mille ülesanne on geeni- ja terviseuuringute läbiviimine, et leida haigusi põhjustavaid geene. Segaduste vältimiseks tuleb kohe lisada, et GV ei tähenda geneetiliste haiguste testimist. Geeniteste üht või teist konkreetset geneetilist haigust põhjustavate geenidefektide väljaselgitamiseks on tehtud Eestis juba rida aastaid ja sellesuunaline uurimistöö jätkub kindlasti ka tulevikus. GV eesmärk on vaadata probleemi kompleksselt ja jõuda pärilikkusaine (DNA) ja haiguste assotsiatsiooniuuringute kaudu uute teadmisteni, mis võimaldaksid ennetada geenidest põhjustatud haigusi. Kogutud terviseandmetest luuakse andmekogu ja DNA-st geenipank, mille infot analüüsides seotakse iga inimese tervisenäitajad tema geeniandmetega. Tulemuseks on umbisikuline andmekogu, milles sisalduvate haiguste ja neid põhjustavate genotüüpide võrdlemisel saaks uurida teatud haiguste seoseid konkreetsete geenidega. Terviseandmete kogumine ehk fenotüpiseerimineGV projekt koosneb reast alaprojektidest. Fenotüpiseerimise raames soovitakse koguda umbes ühe miljoni inimese terviseandmed, mis tähendab kogu Eesti täiskasvanud elanikkonna kaasamist. GV projektis osalemine on vabatahtlik. Ühtki inimest ei saa ega tohi selleks sundida. Terviseandmete kogujatena on planeeritud kasutada perearste. Loomulikult eelneb terviseandmete kogumisele vastav andmekogujate koolitus. Kes ja kuidas saab geenidooniriks?Siit tuleneb ka kaks võimalust, kuidas inimesi projekti haarata: · kui inimesel tekib soov projektis osaleda, siis pöördub ta arsti poole; · arst teeb talle ettepaneku GV projektis osalemiseks. Mõlemal juhul informeerib arst inimest põhjalikult projekti olemuse ja eesmärkide kohta. Inimese nõusolek GV projektis osalemiseks kinnitatakse kirjalikult, millega geenidoonor nõustub temalt kogutava kliinilise ja geneetilise informatsiooni kasutamisega teaduslikel eesmärkidel. Kirjalikud nõusolekud kogutakse projektile õigusliku aluse loomiseks. Eesti tippjuristidest koosnev GV õigusloome töörühm on välja töötanud spetsiaalse GV seaduse, mis sätestab täpselt, kuidas tohib või ei tohi kasutada projekti käigus kogutud informatsiooni, kaitstes geenidoonori isiku konfidentsiaalsust geeniandmete kuritarvitamise eest. Geenidoonori kohta kogutavad isikuandmed kodeeritakse ja tagatakse sellega nende salastatus. Antud projekti puhul on plaanis kaasata Eesti parimaid infotehnoloogia spetsialiste. Milliseid andmeid geenidoonorilt tahetakse?Iga geenidoonori kohta täidab arst terviseandmete vormi, mille puhul kasutatakse nii küsitlust kui ka paralleelselt arsti käsutuses olevat haiguslugudele toetuvat meditsiinilist informatsiooni. Eesmärk on koostada iga geenidoonori kohta võimalikult täpne terviseandmete kogum, kusjuures arvestatakse ka sugupuu andmeid. Kui tervisandmed on kogutud, võetakse igalt geenidoonorilt ka vereproov, millest eraldatakse DNA. Põhimõtteliselt on DNA-d võimalik eraldada igast tuumaga rakust, näiteks nahast, juustest ja isegi süljest. Kuid analüüsideks piisava koguse DNA saamiseks on kõige otstarbekam seda teha siiski verest, mille väikese koguse eraldamine on lihtne ja ei kujuta ohtu geenidoonorile. Geneetiliste andmete kogumine ehk genotüpiseerimineIgale geenidoonorile koostatakse geenikaart. Iga tundmatu objekti kaardistamiseks on esmalt vaja omada kindlaid pidepunkte ehk orientiire. Geeniteaduses on juba paar-kolm aastakümmet kasutatud geenide kaardistamiseks polümorfisme ehk erinevate indiviidide geenide ja geenidevaheliste alade teatud järjestuste väikseid erinevusi. Kuna iga inimese genoom on unikaalne, siis taoliste polümorfismide analüüsil põhinebki nn. DNA sõrmejälgede meetod, mida kasutatakse isikute identifitseerimiseks või näiteks isaduse tuvastamiseks. Antud juhul määratakse teatud kindlates genoomi piirkondades, mis tavaliselt paiknevad väljaspool valke kodeerivaid geene, asuvaid lühikeste polümorfsete piirkondade ehk markerite pikkusi. Neid markereid nimetatakse mikrosatelliit-DNA-ks. Erinevalt isiku tuvastamisest, mille puhul tavaliselt piisab 10-15 eri markeri analüüsist, on GV projekti puhul eesmärk taoliste markeritega ära katta kogu inimese genoom. Seetõttu on Eesti teadlaste huviorbiidis nn. üksiku nukleotiidi polümorfismid (ingl. k. Single Nucleotide Polymorphisms (SNPs)). Need on markerid, millest on rahvusvahelistes teadusringkondades viimase kolme-nelja aasta jooksul järjest enam kõneldud ja seda eelkõige tänu nende potentsiaalsele kasutamisele assotsiatsiooniuuringutel. Võrreldes mikrosatelliit-DNA-ga, paiknevad SNP-d genoomis tunduvalt tihedamalt (üks SNP 300 kuni 1000 aluspaari DNA kohta). Samuti asuvad nad genoomis nii valku kodeerivates, regulatoorsetes kui ka mittekodeerivates alades. Kuna SNP-de puhul on tavaliselt tegemist ühe nukleotiidi erinevusega kahe eri inimese geenijärjestuste vahel, siis nimetatakse neid vahel ka binaarseteks markeriteks. Näiteks: kui ühel inimesel on DNA ahela teatud positsioonis C-nukleotiid, siis teisel inimesel võib samas kohas paikneda T-nukleotiid. Kui taoline asendus on toimunud mingit valku kodeerivas geenis, siis võib selle tulemuseks olla aminohappe ja seeläbi ka valgu funktsiooni muutus. Alati siiski asi niikaugele ei lähe, kuid sellegipoolest on võimalik kasutada taolist varieeruvat nukleotiidi markerina. Tuleb kindlasti lisada, et peamiseks SNP-de eeliseks loetakse nende analüüsi lihtsust ja unifitseeritavust, mis võimaldab neid analüüsida korraga tuhandeid või isegi sadu tuhandeid, kasutades selleks näiteks geenikiibi tehnoloogiat. Kui valida SNP markerid üle kogu genoomi, on võimalik panna paika terve orientiiride süsteem, mis võimaldab meil saada pidepunktid inimese genoomi 3 miljardi nukleotiidi seas. Kust on aga võimalik saada SNP-d, mida soovitakse taolisel kaardistamisel kasutada? Nende avastamine ja kirjeldamine ei ole Eesti GV projekti eesmärk. Käesoleva aasta suvel lõpeb Inimese Genoomi Programmi (Human Genome Program ehk HGP) esimene etapp, mille tulemusel määratakse kogu inimese genoomi nukleotiidne järjestus esialgse visandi (working draft) tasemel. SNP-d on HGP käigus tekkiva informatsiooni "kõrvalproduktiks" ja pannakse nagu genoomi järjestuski vastavatesse andmebaasidesse, millest siis uurijatel on võimalik neid võtta ja kasutada. Eesti GV projekti eesmärk on koostada igale inimesele genotüüp, kus SNP markerite sagedus oleks piisavalt suur, et sellele toetudes saaks läbi viia assotsiatsiooniuuringuid, mis põhinevad geneetilise aheldatuse mittetasakaalulisuse (ingl. k. linkage disequilibrium (LD)) avastamisel. Me kõik pärineme inimsoo esiisast ja -emast. Nimetame neid Aadamaks ja Eevaks. Kui nende järeltulijatel, meie kaugetel esivanematel, tekkis kunagi genoomis teatud haigust põhjustav muutus (mutatsioon), on alust loota, et mutatsiooni piirkonnas on säilinud originaalne DNA nukleotiidne järjestus, mis oli inimesel, kellel mutatsioon tuhandeid aastaid tagasi tekkis. Sellel DNA lõigul on teatud ulatuses säilinud iseloomulik SNP markerite muster, mis on edasi kandunud põlvest põlve. Loomulikult tuleb siin arvestada asjaoluga, et mutatsiooni piirkonnale iseloomulik SNP-de muster on põlvkondade jooksul pidevalt lühenenud meiooside käigus toimuvate geneetilise materjali rekombinatsioonide tagajärjel. (Vaata joonised)
MEIOOSI KÄIGUS TOIMUB GENEETILISE MATERJALI
VAHETUS EHK REKOMBINATSIOON SUGURAKKUDE SAMADE KROMOSOOMIDE ISA-
JA EMAPOOLSE KOOPIA VAHEL, MILLE TÕTTU EI SAA LAPS OMA
VANEMATE KROMOSOOMIDE TÄPSEID KOOPIAID. SELLE ALUSESKS ON
CROSSING-OVER'I Küsimusele, kui pikk on see ala genoomis, kus endiselt on säilinud esialgne SNP-de muster, ei ole praegu teadlaste ringkondades ühest vastust. Kuid üksikute geenide puhul läbiviidud uuringute käigus on leitud, et sellise ala pikkus võib olla isegi kuni 100 000 aluspaari mutatsioonikohast eemal. Antud küsimus on GV projekti seisukohast väga oluline, et teada kogu genoomi katmiseks vajaminevate markerite arvu. Lähtudes ülaltoodud arvudest, õnnestuks kogu genoom "ära katta" umbes 30000 markeriga. GV projekti genotüpiseerimise käigus soovitakse määrata kõigil projektis osalevatel inimestel samades positsioonides asuvate markerite info. Informatsiooni kasutusvõimalused, infoanalüüsKui teadlaste käsutuses on terviseandmed ühe miljoni inimese kohta, on võimalik hakata inimesi vastavalt nende andmetele grupeerima. Näiteks ühe grupi moodustaksid inimesed, kellel on diabeet, teise grupi inimesed, kellel on kõrgenenud vererõhk, kolmanda näiteks mingi kuulmisprobleemiga isikud jne. Loomulikult moodustaksid vähemalt esialgu kõige suurema grupi inimesed, kellel mingit meditsiinilist probleemi ei täheldatud. Nemad oleksid kontrollgrupp. Järgnevalt hakatakse konkreetseid fenotüübi gruppe kokku viima nende isikute genotüüpidega. Kui nüüd selgub, et näiteks kuulmispuudega inimeste grupil on teatud genoomi piirkonnas iseloomulik SNP markerite muster, mis erineb kontrollindiviidide vastava piirkonna SNP markerite omast, siis tõenäoliselt asubki selles piirkonnas mingi geen (või geenid), mis vastutavad antud probleemi tekke eest. Seega - grupeerides meditsiinilist informatsiooni ja võrreldes seda geneetilise informatsiooniga, saab koguda hulgaliselt huvitavat meditsiinilist teavet. Haige patsient saab teada oma tõvest, teiste inimeste jaoks omab taoline informatsioon ennetavat väärtust. Inimene, kes on küll näiliselt igati virk ja kraps, võib omada eelsoodumust teatud haiguse tekkeks, mida saab välja lugeda tema geneetilisest informatsioonist. Siit tulenebki tagasiside GV projektist osalevatele inimestele. Kuigi kogu tervise- ja geenialane info, millega taoliste assotsiatsiooniuuringute raames opereeritakse, on umbisikuline, on GV projektis osalenud inimesel siiski võimalik minna tagasi oma arsti juurde ja paluda, et arst esitaks päringu GV keskandmepanka. Päringu alusel kodeeritakse antud inimest puudutav informatsioon tagasi isikustatud infoks ja arstil on võimalik seda inimesele tutvustada ja teavitada teda haigusriskidest. Geenivaramu mõju majanduseleGV projektil on lisaks teaduslikule ja tervishoiualasele tulemile ka arvestatav majanduslik tähtsus. Projekti läbiviimiseks luuakse Eestis terve rida kõrgtehnoloogilisi töökohti nii genotüpiseerimise kui ka infotehnoloogia vallas. See peaks kindlustama Eesti positsiooni kõrgtehnoloogilises tulevikuühiskonnas. Samas ei tohi unustada ka ärilist aspekti. Projektist saadav informatsioon on kasutatav farmaatsiatööstuses uute ja paremate ravimite valmistamisel. Neid nimetatakse personaalseteks ravimiteks. Paljud inimesed on kogenud, et üks ja sama ravim ei mõju kõigile ühtmoodi. Selle põhjuseks on väikesed erinevused genoomis. Omades nii haigust põhjustava geeni kui ka ravimi sihtmärgi kohta rohkem informatsiooni, on võimalik arvestada patsientide geneetilist eripära ja valmistada eri patsiendirühmadele spetsiaalselt neile suunatud ravimeid. Sellelaadse informatsiooni eest on rahvusvahelised ravimifirmad valmis maksma suuri summasid. Kuna neile müüdav informatsioon on umbisikuline, ei ole selle alusel võimalik minna konkreetse isikuni. Seetõttu on välistatud info kasutamine geenidoonori huvide vastu. Geenivaramu väljundidMis kasu on ikkagi geenivaramust? Üldjoontes on GV projektil neli olulist väljundit. EsiteksInimese terviseteadlikkuse tõstmine. Objektiivne, genotüübi baasil toimuv riskide hindamine ning selle kaudu inimese tervise parandamine, laiemalt ka tema järglaste ning kaaskondlaste aitamine. TeiseksEesti rahvusvahelise konkurentsivõime kasv. Projektiga kaasnevad infrastruktuuri areng, investeeringud kõrgtehnoloogiasse, samuti kõrgepalgaliste töökohtade ning teadusmahukate toodete ja teenuste tekkimine. KolmandaksKorrastatud andmebaaside (sh. Eesti elanikkonna genotüübi/fenotüübi andmebaas) ja infojuhtimissüsteem loomine tervishoius, mis soodustab innovaatilist teadustööd ja loob lisaväärtust tervishoiusektorile. NeljandaksMajandus- ja haldusalade integreeritud arengu toetamine geenitehnoloogia mitmekülgsete võimaluste ning eri valdkondade (geenitehnoloogia, infotehnoloogia, põllumajandus, tervishoid jne.) koostöö tõhustamise abil.
Artiklis kasutatud mõisteidGenoom - Geenidefekt - Geneetiline aheldus - Geneetiline polümorfismi - geenide ja muude geneetiliste lookuste mitmekesisus populatsiooni (liigi) indiviidide hulgas. Samas kromosoomilookuses esinevad eri indiviididel erinevad geenialleelid või muude markerite teisendid. Mikrosatelliit-DNA - Üksiknukleotiidne polümorfism - genoomilookuste mitmekesisus populatsioonis, mis on tingitud ühe ainsa nukleeotiidipaari asendusest vastavas DNA-piirkonnas.
Mart Viikmaa |