Jasper Adamson
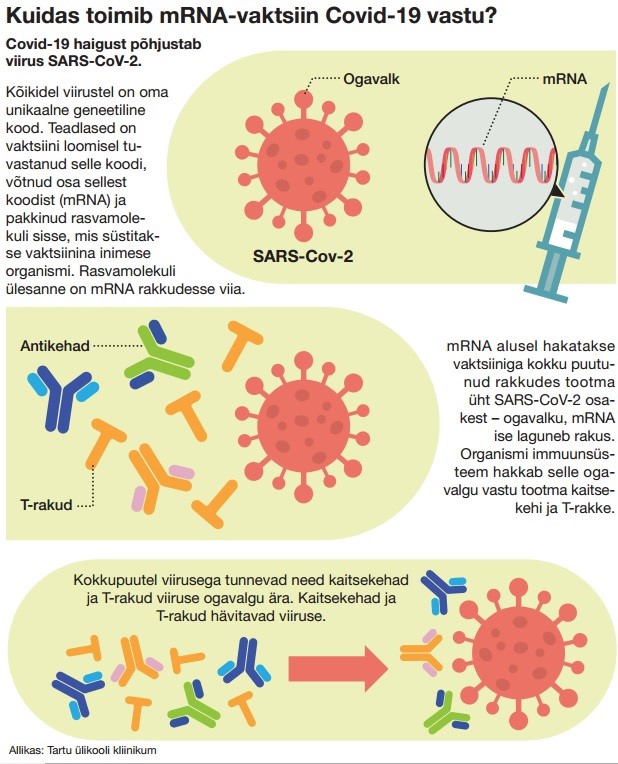
COVID-19 pandeemia ajal kasutati esimest korda nn mRNA-vaktsiine. Nendes ümbritsevad mRNA-d lipiidsed nanoosakesed, mis kaitsevad mRNA-d ensümaatilise lagunemise eest, enne kui see jõuab inimese rakkudesse. mRNA-vaktsiinid toimivad põhimõttel: inimkeha suudab kindla järjestusega mRNA-molekuli põhjal ise sünteesida need valgud, mis aitavad tekitada viiruse vastu immuunkaitse. Praegu uuritakse võimalusi, kuidas luua niisuguseid vaktsiine näiteks HIV-i, malaaria, pähkliallergia ja teiste tervisehädade vastu. Samuti loodetakse mRNA-l põhinevaid ravimeid tulevikus kasutada isegi vähktõve ravis.
mRNA-vaktsiine süstitakse inimese käevarrelihastesse. Nii jõuab mRNA, mis paikneb lipiidsetest nanoosakestest (ingl lipid nanoparticles, LNP) koosnevates kapslites, inimese rakkudesse, kus avaldub tema toime. Rakkudesse jõudnuna LNP-d lagunevad ning mRNA-molekulide vabanedes saab inimorganismis tekkida immuunvastus viirusele, näiteks COVID-19-le. Raku tsütoplasmas olevad molekulaarsed masinad ribosoomid loevad mRNA-d ja toodavad mRNA-s sisalduva geneetilise koodi järgi vajalikku valku.
Tekkinud võõras valk liigub raku pinnale ja lagundatakse väikesteks tükkideks. Selle tõttu aktiveerubki kehas immuunvastus: tekivad antikehad ja T-rakud, mis on valmis sama valku kandva viiruse korral reageerima ja haigustekitajad hävitama. Siinkohal on oluline märkida, et rakkudesse jõudnud mRNA ei muuda inimese pärilikkusainet DNA-d ega jää organismi püsima, vaid laguneb inimkeha loomulike ensüümide toimel juba mõne päeva jooksul.
Kaitsev pakend
Kuid miks on vaja mRNA-molekuli kaitsta ja see vaktsiinis LNP-kapslitesse pakendada? mRNA on geneetiline koodilõik, mis annab rakkudele juhiseid toota teatavaid valke. Need valgud täidavad tavaliselt inimkeha rakkudes eri ülesandeid: osalevad ainevahetuses, toimivad signaalmolekulidena, toetavad rakustruktuuri ja immuunvastust või siis transpordivad aineid raku sees ja rakkude vahel. Kui teadlased olid mõistnud mRNA-vaktsiinide või -ravimite suurt potentsiaali ja hakkasid esimesi katseid tegema, ilmnes kohe kaks probleemi. Nimelt on mRNA loomulikul kujul väga ebastabiilne ja laguneb ensüümide toimel kiiresti, enne kui jõuab rakkudesse. Samas on väga tähtis jõuda rakkudesse, sest muidu ei saa rakkude sees sünteesida soovitud valke. Teisalt tekitab muutmata kujul mRNA kehas tugeva immuunreaktsiooni, mille tõttu on teda raske ravi otstarbel kasutada.
Selleks et mRNA-d kaitsta ja et see jõuaks rakkudesse lagunemata, katsetati LNP-kapsleid, mis aitavad transportida mRNA rakkudesse. LNP-d on umbes 80–120 nm läbimõõduga ning neljast koostisosast loodud tehisosakesed. Neid võib ette kujutada kui mikroskoopilisi kapsleid, mille sisse on pakitud mRNA. Kuna rakumembraanid koosnevad LNP-dele sarnaste omadustega molekulidest, on LNP-del loomulik võime rakupinda läbida ja nõnda ka mRNA rakku viia. Just seetõttu ongi nendest nanoosakestest saanud põhimoodus, toimetamaks kohale mRNA-ravimeid ja -vaktsiine.
Igal pakendi koostisosal on oma ülesanne
Tüüpiline LNP on keeruline segu komponentidest, millest igaühel on oma roll. Esimesed neist, ioniseeritavad katioonsed lipiidid, saavad muuta oma elektrilaengut olenevalt lähikeskkonna pH-st. Happelises keskkonnas, näiteks tootmise käigus või raku sees transpordiunktsiooni täitvas endosoomis, omandavad nad positiivse laengu, mis aitab siduda negatiivselt laetud mRNA-d ja hiljem seda rakus vabastada. Füsioloogilise tasemega pH korral, näiteks veres, jäävad nad aga neutraalseks. See asjaolu vähendab LNP-de toksilisust ega lase nanokapslitel enne rakku jõudmist laguneda.
LNP-de teine koostisosa on fosfolipiidid, mis sarnanevad rakumembraani loomulike fosfolipiididega. Need stabiliseerivad LNP-de ülesehitust, andes osakestele mehaanilise tugevuse, ja aitavad ühilduda rakumembraaniga, et tagada mRNA transport rakkudesse.